Actualización, 20 de diciembre: El 16 de diciembre, un comité asesor de los Centros para el Control y la Prevención de Enfermedades votó para recomendar preferentemente las vacunas de Pfizer/BioNTech y de Moderna por sobre la de J&J debido al riesgo de un tipo de coágulo sanguíneo grave y poco frecuente en combinación con un nivel bajo de plaquetas. Los CDC apoyaron esa recomendación el mismo día. Para más información vea nuestra guía para la vacuna de Johnson & Johnson.
Actualización, 6 de mayo, 2022: El 5 de mayo, la FDA limitó la autorización de uso de la vacuna de J&J a adultos que no pudieran recibir otra vacuna contra el COVID-19 autorizada o aprobada por razones médicas o de acceso, o que solo quisieran esa vacuna para protegerse contra el COVID-19. La decisión de la FDA se basó en la evaluación del riesgo poco común de TTS y la disponibilidad de otras vacunas que no han mostrado riesgo para esa afección. Al 7 de abril, 2022, los CDC y la FDA han confirmado 60 casos, incluyendo nueve muertes, entre más de 18,6 millones de dosis administradas de la vacuna de J&J.
Hasta ahora, se han administrado cerca de 200 millones de dosis de vacunas contra el COVID-19 en Estados Unidos, incluyendo 7,2 millones de dosis de la vacuna de Johnson & Johnson. Luego de seis casos reportados de “un tipo raro y severo de trombos o coágulos de sangre” en personas que recibieron la vacuna de J&J en este país, los Centros para el Control y la Prevención de Enfermedades (CDC, por sus siglas en inglés) y la Administración de Alimentos y Medicamentos de los EE.UU. (FDA, por sus siglas en inglés) decidieron recomendar “una pausa en el uso” de la vacuna de J&J “como medida extrema de precaución”.
Los seis casos ocurrieron en mujeres de entre 18 y 48 años de edad, según una declaración conjunta de las dos agencias, y sus síntomas (severos dolores de cabeza, abdomen y piernas, y falta de aliento) se presentaron de seis a 13 días después de haber recibido la vacuna de J&J. Una de las mujeres falleció y otra permanece en condiciones críticas, dijo Peter Marks, director del Centro para la Evaluación e Investigación de los Productos Biológicos de la FDA, en una conferencia de prensa el 13 de abril.
 La pausa recomendada solo incluye a la vacuna de Johnson & Johnson, la cual usa una tecnología distinta a la de las otras dos vacunas que han sido aprobadas en los Estados Unidos y que han sido administradores en números mucho mayores.
La pausa recomendada solo incluye a la vacuna de Johnson & Johnson, la cual usa una tecnología distinta a la de las otras dos vacunas que han sido aprobadas en los Estados Unidos y que han sido administradores en números mucho mayores.
“No ha habido señales de alarma” en las vacunas de Pfizer/BioNTech y de Moderna, dijo el doctor Anthony Fauci, director del Instituto Nacional de Alergias y Enfermedades Infecciosas, en otra conferencia de prensa realizada el 13 de abril en la Casa Blanca.
Las seis mujeres sufrieron de un tipo de trombos o coágulo de sangre llamado trombosis de los senos venosos cerebrales (CVST, por sus siglas en inglés) en combinación con bajos niveles de plaquetas, una condición llamada trombocitopenia.
A pesar de que los casos son muy escasos y muy poco comunes, Marks dijo que las agencias actuaron rápidamente porque el tratamiento habitual para los coágulos de sangre, un anticoagulante llamado heparina, “puede, en realidad, causar un daño tremendo o causar un resultado fatal”.
“Por lo que debemos asegurarnos de que los proveedores de salud estén al tanto de que si ven personas con bajos niveles de plaquetas, o si ven gente que ha tenido coágulos de sangre, tienen que preguntar sobre el historial de vacunas recientes y luego actuar acordemente en el diagnóstico y el manejo de esos individuos”, dijo Marks. “Esto fue decidido rápidamente para honrar nuestro compromiso con el público estadounidense de garantizar que cualquier señal de alarma sobre la seguridad de las vacunas que apareciera durante el proceso de vacunación sería abordado de una manera completamente transparente”.
En la conferencia de prensa, la comisionada interina de la FDA Janet Woodcock dijo que Comité Asesor sobre Prácticas de Vacunación (ACIP, por sus siglas en inglés) de los CDC se reuniría el 14 de abril para analizar estos casos y evaluar su potencial relevancia. Woodcock dijo que la duración de la pausa dependerá de lo que las agencias descubran en los días siguientes. “Sin embargo, esperamos que será un asunto de días”, dijo Woodcock.

El doctor Paul Offit, director del Centro de Educación de Vacunas del Hospital de Niños de Filadelfia y miembro del comité asesor de vacunas y productos biológicos de la FDA, dijo que la recomendación de pausa es una señal de que los sistemas de monitoreo de la vacuna están funcionando y de que las agencias sí detectaron y tomaron acción de un “efecto secundario muy, muy raro luego de su aprobación”.
“De muchas maneras, esto debiera ser reconfortante para la gente, de alguna forma”, dijo Offit en una entrevista con CNN. “Cuando se realizó este ensayo clínico, el ensayo de Johnson & Johnson en Estados Unidos, involucró a 18.000 personas en EE.UU., 44.000 personas en el mundo. Si este efecto secundario ocurre en una de entre un millón de personas, no vas a ver eso en el proceso antes de la aprobación. Pero ahora que está ahí afuera, debiera ser reconfortante para la gente saber que todavía hay gente monitoreando”.
Actualizacion, 20 de diciembre: Hasta el 8 de diciembre, los CDC y la FDA habían confirmado 57 casos, incluyendo nueve muertes, entre más de 16,9 millones de vacunas de J&J administradas.
A diferencia de las vacunas de Pfizer/BioNTech y de Moderna, las cuales utilizan un diseño ARNm, la vacuna de Johnson & Johnson usa un adenovirus (un tipo de virus que normalmente causa un resfriado común) modificado con el material genético del SARS-CoV-2 para incitar una respuesta inmunitaria.
“Con nuestro intenso sistema de monitoreo, no hemos detectado este tipo de síndrome de bajo nivel de plaquetas entre las otras vacunas”, dijo Anne Schuchat, subdirectora principal de los CDC, refiriéndose a las vacunas de Pfizer/BioNTech y Moderna. “Ahora tenemos evidencia de la efectividad real de las vacunas en Estados Unidos. Estamos tomando esta pausa y precauciones en torno al producto de J&J en el contexto de un gran, robusto y altamente seguro y efectivo esfuerzo de vacunación”.
Un tipo muy poco común de coágulo de sangre
La trombosis de senos venosos cerebrales, o TSVC, que seis mujeres sufrieron tras la vacunación con el producto de J&J es un tipo de coágulo de sangre muy poco frecuente que ocurre en el seno venoso dural que drena sangre desde el cerebro. Johns Hopkins Medicine la describe como un tipo de infarto cerebral poco común.
“Bloquea la irrigación de la sangre desde el cerebro”, según Johns Hopkins.
Schuchat dijo que el riesgo de TSVC es “muy bajo” para aquellos que recibieron la vacuna hace más de un mes. A pesar de que los casos han sido muy escasos, Schuchat dijo: “Aquellos que han recibido la vacuna recientemente, en las últimas dos semanas, deben permanecer atentos a los síntomas. Si ha recibido la vacuna y comienza a sentir dolores severos de cabeza, abdomen o piernas, o siente falta de aliento, debe contactar a su médico y buscar tratamiento médico”.
Marks aclaró que tener síntomas similares a los de un resfrío, incluyendo fiebre, en los primeros días despues de la vacuna es común. “Entonces, para el internista allá afuera o el médico de cabecera recibiendo consultas de sus pacientes, si ven síntomas como los del resfrío y dolor de cabeza en los días siguientes a la vacunación, eso es probablemente lo mismo que hemos estado viendo como reacciones comunes y no graves de las vacunas.”
Carlos del Rio, decano asociado ejecutivo de la Facultad de Medicina de la Universidad de Emory y Grady Health System, le dijo a CNN que los beneficios de la vacuna de Johnson & Johnson superan ampliamente los riesgos para aquellos mayores de 50 años de edad y entre 18 y 20 años.
“Quiero enfatizar que ahora mismo, el beneficio de vacunar supera con creces los riesgos, ya sabe, el riesgo de morir de COVID-19”, dijo a CNN. “Si usted tiene 50 años de edad, o si tiene entre 18 y 20 años de edad, la probabilidad de que tenga este efecto secundario con la vacuna de J&J es una en un millón. Si contrae COVID, su probabilidad de morir a esa edad es de aproximadamente 55 en un millón”.
La incidencia anual de la TSVC en la población general es de dos a 14 personas entre un millón, según dijo Marks en la conferencia de prensa. El problema, sin embargo, es que los seis casos de TSVC, los cuales representan menos de uno en un millón de aquellos que han recibido la vacuna de J&J, también presentaron niveles bajos de plaquetas.
“Lo que es realmente notable aquí no es solo la trombosis de senos venosos cerebrales o la trombocitopenia. Ambas condiciones pueden ocurrir”, dijo Marks. “Pero el hecho de que ocurran al mismo tiempo, eso es lo que marca el patrón. Y ese patrón es muy, muy similar a lo que se ha visto en Europa con otra vacuna. Entonces, creo que tenemos que tomarnos el tiempo para entender esta complicación y para abordarla apropiadamente”.
AstraZeneca en Europa
Al igual que los casos reportados en Estados Unidos con la vacuna de Johnson & Johnson, la mayoría de los casos detectados en Europa han ocurrido en mujeres menores de 60 años de edad, a dos semanas de recibir la vacuna de AstraZeneca, de acuerdo a la comité de seguridad de la Agencia Europea de Medicamentos (EMA, por sus siglas en inglés).
La EMA emitió un comunicado el 7 de abril diciendo que concluyó que “la inusual combinación de coágulos sanguíneos y plaquetas bajas en sangre debe incluirse como un raro efecto secundario” de la vacuna contra el COVID-19 de AstraZeneca, también conocida como Vaxzevria.
Al 22 de marzo, el Comité para la Evaluación de Riesgos en Farmacovigilancia europeo (PRAC, por sus siglas en inglés) analizó 62 casos de coágulos de sangre en el cerebro y 24 casos de coágulos sanguíneos en el abdomen, o trombosis venosa esplácnica, reportados en el Espacio Económico Europeo y el Reino Unido, donde 25 millones de personas han recibido la vacuna. Dieciocho de los casos fueron fatales.
El comité declaró que una posible explicación para la rara combinación de coágulos y plaquetas bajas “es una respuesta inmunitaria, que desencadena una condición similar a una vista en algunas ocasiones en pacientes tratados con heparina (trombocitopenia inducida por heparina)”, un anticoagulante común y potente.
Similarmente, Marks dijo en la conferencia de prensa de los CDC y la FDA que a pesar de que no hay una “causa definitiva” para la reacción adversa en los seis casos en EE.UU., la “causa probable” puede ser “una respuesta inmunitaria que ocurre muy, muy raramente después de que algunas personas reciben una vacuna, y esa respuesta inmunitaria desencadena la activación de las plaquetas, y este tipo extremadamente raro de coágulos de sangre”.
De acuerdo a una nota publicada por la revista Science el 11 de abril, en Europa se han reportado al menos 222 casos probables, luego de que 34 millones de personas hayan recibido la primera dosis de la vacuna de AstraZeneca, y más de 30 han fallecido.
Un equipo de científicos liderados por el experto en coágulos Andreas Greinacher de la Universidad de Greifswald ha estado estudiando 11 casos en Alemania y Austria de lo que él llama “vaccine-induced immune thrombotic thrombocytopenia” (trombocitopenia trombótica inmunitaria inducida por la vacuna). Un segundo equipo evaluó cinco casos en Noruega. Ambos asemejaron el síndrome con lo que los doctores ven en pacientes tratados con heparina, de acuerdo a una nota de STAT.
La EMA concluyó que dados los riesgos asociados al COVID-19 y al hecho de que la combinación de coágulos de sangre y niveles bajos de plaquetas “es muy escasa”, “los beneficios generales de la vacuna de prevenir el COVID-19 superan los riesgos de los efectos secundarios”. Pero según Science, varios países europeos están restringiendo el uso de la vacuna de AstraZeneca en jóvenes que tienen menos riesgos de enfermarse gravemente de COVID-19. Alemania está usando la vacuna solo en personas mayores de 60 años de edad, Francia en personas mayores de 55 años, y el Reino Unido está recomendando que las personas menores de 30 años de edad reciban otra vacuna.
Johnson & Johnson había comenzado a distribuir dosis de su vacuna contra e COVID-19 en países europeos el 12 de abril. Pero al día siguiente, la compañía anunció en un comunicado que estaba analizando los casos en EE.UU. con las autoridades sanitarias europeas y había “decidido proactivamente retrasar la distribución de nuestras vacunas en Europa”.
“Hemos estado trabajando muy de cerca con los expertos y autoridades de salud, y apoyamos completamente mantener una comunicación abierta con los profesionales de la salud y el público”, dice el comunicado.
Ensayos clínicos de Johnson & Johnson
La FDA autorizó el uso de emergencia de la vacuna de una dosis elaborada por Janssen Biotech Inc., una empresa farmacéutica de Johnson & Johnson, el 27 de febrero.
Entonces, por qué no se detectó antes esta reacción adversa de coágulos sanguíneos en los ensayos clínicos de J&J, CNN le preguntó a Offit.
“Porque son muy escasos”, dijo Offit. “Si usted mira la forma en que J&J hizo su ensayo, que incluyó cerca de 44.000 personas, 18.000 en EE.UU., si un evento ocurre en una de entre un millón de personas, entonces es poco probable que lo vea. Pero, al mismo tiempo, quiero decir que debiera ser reconfortante para la gente saber que siempre estamos mirando, siempre mirando para asegurarnos que no haya siquiera un efecto secundario muy, muy escaso. Y eso debiera ser reconfortante para la gente”.
Como hemos reportado, el ensayo clínico de fase 3 de J&J incluyó a 44.325 voluntarios, de los cuales 21.895 recibieron la vacuna y 21.888 el placebo.
La FDA determinó que tres eventos adversos serios no fatales en el grupo de la vacuna estuvieron probablemente relacionados con la vacuna: una reacción hipersensible que ocasionó urticaria o erupciones, dolor en el lugar del pinchazo no aliviada por medicamentos sin receta médica, y un caso que incluyó síntomas por algunos días de “malestar general, debilidad, mialgia, falta de aliento, dolor de cabeza, sensación de adormecimiento y hormigueo en las extremidades superiores, dolor de pecho y fiebre”.
El análisis de seguridad “apoyó dar un perfil favorable de seguridad sin identificar ninguna preocupación específica de seguridad que pudiera impedir la autorización de una EUA”, según el documento de la FDA.
En el ensayo se reportó un caso de un hombre de 25 años de edad que sufrió una trombosis de senos venosos 21 días después de recibir la vacuna de J&J. El ensayo hizo una pausa para evaluar el evento pero se determinó que la reacción no fue causada por la vacuna.
“Luego de una extensa investigación y consulta con expertos no se identificó una causa clara de la reacción; sin embargo se sugirieron algunos factores que probablemente influyeron, tales como una infección anterior y una anomalía anatómica”, según el documento de la FDA. “La hoja del investigador y el formulario de consentimiento informado se modificaron acordemente, y se levantó la pausa del estudio. El análisis final del investigador y el patrocinador fue que el evento no estuvo relacionado con el producto estudiado”.
Impacto en las metas de vacunación en EE.UU.
Los CDC y la FDA no ordenaron suspender la administración de la vacuna de J&J y, como explicamos anteriormente, no se espera que la pausa dure por mucho tiempo.
“Esta es una recomendación, no un mandato”, dijo Marks. “Estamos recomendando que la administración de la vacuna sea pausada como una medida de extremada precaución. Sin embargo, si un determinado médico tiene una conversación con un determinado paciente y concluyen que la relación riesgo-beneficio para ese paciente determinado es apropiada, no vamos a prohibirle a ese médico darle la vacuna a su paciente, porque en muchos casos puede ser lo correcto, que en la gran mayoría de los casos el beneficio general de recibir la vacuna supere la posibilidad de riesgo”.
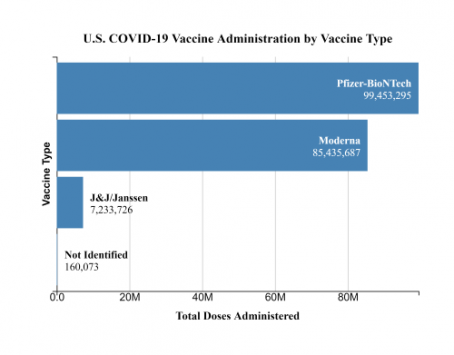
La pausa recomendada no debiera alterar la meta del presidente Joe Biden de administrar 200 millones de dosis en sus primeros 100 días. Jeff Zients, coordinador de la respuesta al COVID-19 de la Casa Blanca, dijo que la vacuna de Johnson & Johnson representa menos de un 5% del total de vacunas administradas en EE.UU. hasta ahora.
“Estados Unidos ha asegurado suficientes dosis de Pfizer y Moderna para 300 millones de estadounidenses”, dijo Zients. “Este suministro es más que suficiente para continuar con el ritmo de vacunación actual, de 3 millones de inyecciones diarias, y para alcanzar la meta del presidente de 200 millones de dosis a los cien días de su presidencia, y para continuar y vacunar a cada adulto que así lo desee”.
Del Río elogió a los CDC y la FDA por actuar rápidamente y priorizar la seguridad de las vacunas, en su entrevista con CNN. Dijo que le preocupaba, sin embargo, que la recomendación de pausa pudiera aumentar la renuencia a las vacunas, a pesar de la abrumadora evidencia de que los beneficios de las vacunas contra el COVID-19 superan los escasos riesgos.
“Estas vacunas ya han salvado miles de vidas”, dijo. “La gente ha visto, hemos visto, la tasa de mortalidad bajar en los EE.UU. a pesar de que los casos han subido y eso es porque hemos vacunado a la gente. … Sigo recomendando a la gente que se vacune. No le diría a la gente que se dejara de vacunar por este efecto secundario tan escaso”.
Traducido por Catalina Jaramillo.
Nota del editor: El Proyecto de Vacunación/COVID-19 de SciCheck es posible gracias a una beca de la Robert Wood Johnson Foundation. La fundación no tiene control alguno sobre nuestras decisiones editoriales, y los puntos de vista expresados en nuestros artículos no reflejan necesariamente el punto de vista de la fundación. El objetivo del proyecto es aumentar el acceso a información precisa sobre el COVID-19 y las vacunas, y reducir el impacto de información errónea.